(Compendio del contenido de la Clase de la Catedra de Docencia Libre de Neurociencias 2 de la UMAX del sabado 3 de marzo de 2018)
GENERALIDADES ACERCA DEL DOLOR
El dolor es la razón más frecuente por la que un paciente solicita asistencia médica. Tiene componentes sensitivos y emocionales, y a menudo se clasifica como agudo o crónico. Con frecuencia, el dolor agudo se asocia con ansiedad e hiperactividad del sistema nervioso simpático (p. ej., taquicardia, aumento de la frecuencia respiratoria y de la tensión arterial, diaforesis, pupilas dilatadas).
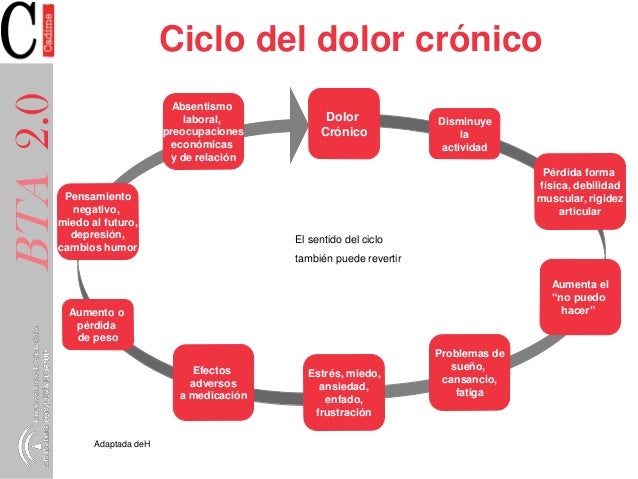
El dolor crónico es el dolor que se prolonga más allá del tiempo de curación normal y carece del sentido normal de advertencia nociceptiva. Habitualmente esto significa períodos continuos de dolor que superan los tres a seis meses de duración. Suele no responder a los tratamientos y acompañarse de trastornos psicológicos
El dolor crónico no incluye hiperactividad simpática, pero puede asociarse con signos vegetativos (p. ej., fatiga, pérdida de la libido, pérdida del apetito) y depresión del estado de ánimo. Las personas varían considerablemente en su tolerancia al dolor.
El dolor agudo es la respuesta fisiológica normal y predecible a un estímulo nocivo (doloroso). Está claramente localizado y su intensidad se correlaciona con el estímulo. A diferencia del dolor crónico, el dolor agudo es de duración limitada y remite cuando la lesión desaparece o se cura.
FISIOPATOLOGIA DEL DOLOR
a. Dolor neuropatico
El dolor neuropático resulta de un daño o enfermedad que afecta el sistema somatosensorial. y puede estar asociado con sensaciones anormales llamadas disestesia y dolor producido por estímulos normalmente no dolorosas (alodinia-hiperestesia). El dolor neuropático puede tener componentes continuos y /o episódicos (paroxística). Es causado por un sistema nervioso
con función alterada. La injuria del sistema nervioso y la patología causal pueden
encontrarse a cualquier nivel del neuroaxis. Puede haber una lesión en la periferia
causada por una injuria directa a los nervios periféricos ocasionando una sección,
compresión, estiramiento o atrapamiento e inflamación. Estas circunstancias resultan en
injuria axonal y puede presentarse un estado de dolor persistente. La transección
causada por procedimientos quirúrgicos tales como amputación o como resultado de un
trauma pueden producir la formación de neuromas que son causa de dolores
persistentes.
Una causa común de dolor y de atrapamiento es una invasión tumoral, que
resulta en una injuria compresiva isquémica a un nervio periférico. Algunas enfermedades
sistémicas tales como la diabetes o aquellas que producen deficiencias nutricionales,
pueden afectar las actividades metabólicas celulares en el sistema nervioso periférico y
causar dolor asociado con alteraciones patológicas de las vías sensoriales. Es más,
cualquier alteración patológica de la estructura y función de los nervios periféricos puede
ser un estímulo primario que inicia el desarrollo de un dolor neuropático.
La actividad
inflamatoria de las citoquinas podría ser un factor causal de ciertos síndromes
neuropáticos. Alteran el axón normal y la actividad de las células Schwann normales,
específicamente modificando la electrofisiología celular y la expresión del gen.
Luego de la lesión se produce la regeneración. Si la regeneración se
dificulta por la presencia de cicatrices celulares u otro bloqueo, las fibras de regeneración
pueden formar un neuroma y nunca llegar a su órgano blanco. Las fibras de regeneración
pueden incrementar el número de canales de sodio presentes en la membrana celular para permitir un mayor pasaje de iones sodio, por lo tanto proveen a la fibra de una
sensibilidad alterada que puede llevar a que el axón tenga una conductividad anormal.
Los cambios espinales que se presentan luego de las lesiones del nervio periférico
incluyen marcada diferencia en la cantidad medular de neurotrasmisores, neuropéptidos y
sus receptores, hiperactividad de las células del asta dorsal profunda, y crecimiento
anormal de fibras de nervios periféricos hacia la lámina espinal. Las vías espinotalámicas
pueden también demostrar hiperactividad electrofisiológica que se correlaciona con
imbalance neuroquímico de la médula espinal. Por lo tanto, el cambio del entorno celular
y los cambios químicos en el sitio de la injuria del nervio periférico puede influenciar a la
médula espinal y al cerebro, a través de la alteración de la secreción de los
neurotransmisores y neuropéptidos o a través de la regeneración de fibras aferentes,
hacia la médula espinal
El dolor neuropático puede persistir a pesar de la ausencia de una injuria
persistente. La presentación del dolor neuropático puede demorar meses o años e
inesperadamente puede producir déficit sensorial concomitante. El dolor es persistente y
en muchos casos debilitante. Un examen sensitivo del paciente presenta muchas
anormalidades y quizás atrofia muscular asociados con la protección y desuso de un
miembro. Los síntomas sensoriales pueden incluir hiperalgesia, que es la respuesta
exagerada a un estímulo nocivo, y alodinia, que consiste en tener una respuesta dolorosa
a un estímulo normalmente no doloroso. La hiperalgesia secundaria y alodinia presentes
son usualmente refractarias a la terapia convencional indicadas para el dolor agudo. Los
opioides para que sean útiles en este tipo de dolor deben darse en dosis tan altas que no
son prácticas para un paciente ambulatorio.
Los cambios periféricos más comunes que desencadenan un dolor
neuropático son:
- Patologías que definen una degeneración walleriana
- Regeneración anormal de fibras lesionadas
- Cambios a nivel del nervio periférico que desarrolla una interacción
neuroinmunológica
- Aumento aberrante de inervación simpática al ganglio de la raíz dorsal
- Hiperexitabilidad electrofisiológica de las neurofibras
Ya que el dolor es una experiencia de la persona y no meramente un
impulso nociceptivo o neuropático, el terapeuta del dolor debe tener una apreciación del
“dolor total”
b. Dolor nociceptivo
El dolor nociceptivo es causado por la estimulación de un sistema
nervioso intacto que funciona normalmente. Por la diferencia en el patrón de inervación,
el dolor nociceptivo puede ser clasificado como:
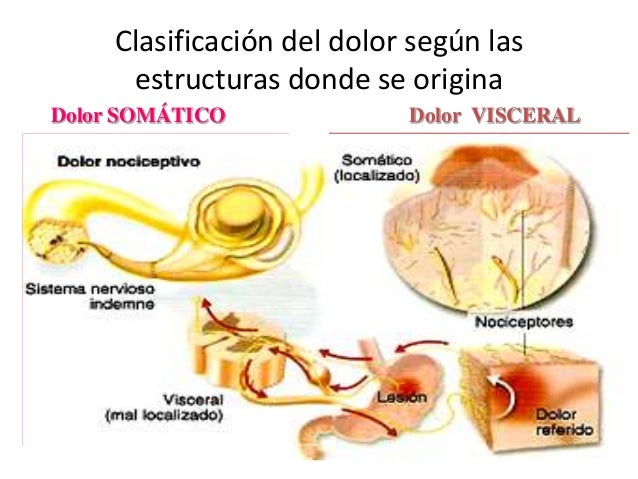
- Somático: áreas superficiales muy inervadas con una localización precisa
del dolor.
- Visceral: órganos inervados difusamente con pobre localización del dolor.
El dolor nociceptivo es beneficioso para el organismo ya que invoca
acciones de protección y defensa para evitar mayor daño y para ayudar en la reparación
tisular y regeneración. A
pesar de que puede haber un periodo de dolor severo que se origina por irritación de las
fibras sensitivas en el sitio de la injuria y hay un periodo transitorio de hiperalgesia
secundaria en los dermatomas vecinos mediados por sensibilización central transitoria de
las neuronas de rango dinámico amplio, la reparación del área afectada se asocia con la
resolución del dolor. Resulta del daño a la piel u otro tejido periférico y es transmitido a través de receptores sensoriales, neuronas aferentes, y vías
nociceptivas espinotalámicas ascendentes. Es modulado por vías descendentes inhibitorias .Es una respuesta normal y fisiológica para protección tisular. Resulta en un aumento de actividad de neuronas espinales de rango dinámico
amplio en la lámina dorsal profunda. Es sensible a terapia con opioides.
El dolor agudo, que suele aparecer en respuesta a la lesión tisular, es el resultado de la activación de los receptores periféricos del dolor y sus fibras nerviosas sensitivas A delta y C específicas (nociceptores).
El dolor crónico relacionado con la lesión tisular continua presumiblemente es causado por las activación persistente de estas fibras. Sin embargo, la gravedad de la lesión de los tejidos no siempre predice la gravedad del dolor crónico o agudo. El dolor crónico también puede ser el resultado del daño continuo o de la disfunción del sistema nervioso periférico o central (que produce dolor neuropático).
El dolor nociceptivo puede ser somático o visceral.
Los receptores para el dolor somático se localizan en la piel, los tejidos subcutáneos, las aponeurosis, otros tejidos conectivos, el periostio, el endostio y las cápsulas articulares. La estimulación de estos receptores suele producir un dolor localizado agudo o sordo, pero el ardor no es infrecuente cuando se afectan la piel y los tejidos subcutáneos.
Los receptores de dolor visceral se encuentran en la mayoría de las vísceras y el tejido conectivo circundante. El dolor visceral debido a obstrucción de un órgano hueco es localizado, profundo y de tipo cólico y puede ser referido a un punto remoto de la piel. El dolor visceral ocasionado por un daño sufrido en las envolturas de los órganos u otros tejidos conectivos profundos puede ser mejor localizado y definido.
Factores psicológicos modulan la intensidad del dolor en un grado muy variable. Los pensamientos y las emociones tienen un papel importante en la percepción del dolor. Muchos pacientes que tienen dolor crónico también tienen trastornos psicológicos, especialmente depresión y ansiedad. Debido a que ciertos síndromes caracterizados como trastornos psiquiátricos (p. ej., algunos trastornos con síntomas somáticos) se definen por el dolor autocomunicado, los pacientes con dolor mal explicado a menudo se caracterizan erróneamente como que tienen un trastorno psiquiátrico y por lo tanto se ven privados de la atención adecuada.
El dolor afecta múltiples dominios cognitivos que incluyen la atención, la memoria, la concentración, y el contenido del pensamiento, posiblemente al exigir recursos cognitivos.
Muchos síndromas de dolor son multifactoriales. Por ejemplo, el dolor dorsal bajo crónico y la mayoría de los síndromes de dolor por cáncer tienen un componente nociceptivo sobresaliente, pero también pueden incluir el dolor neuropático (debido al daño en el nervio).
Transmisión y modulación del dolor
Las fibras para el dolor entran en la médula espinal en los ganglios de la raíz dorsal y hacen sinapsis en el asta posterior. Desde allí, las fibras atraviesan hacia el otro lado y viajan por las columnas laterales hasta el tálamo y luego hasta la corteza cerebral.
La estimulación repetitiva (p. ej., por un trastorno doloroso prolongado) puede sensibilizar a las neuronas del asta dorsal de la médula espinal de modo que un estímulo periférico menor produce dolor (fenómeno de aumento).
Los nervios periféricos y los nervios en otros niveles del SNC también pueden estar sensibilizados y producir cambios sinápticos prolongados en los campos receptivos corticales (remodelación) que mantienen una percepción exagerada del dolor.
Las sustancias liberadas cuando se lesiona un tejido, que incluyen aquellas involucradas en la cascada inflamatoria, pueden sensibilizar a los nociceptores periféricos. Estas sustancias incluyen péptidos vasoactivos (p. ej., proteína relacionada con el gen de la calcitonina, sustancia P, neurocinina A) y otros mediadores (p. ej., prostaglandina E2, serotonina, bradicinina, adrenalina).
La señal para el dolor está modulada en múltiples puntos tanto en vías segmentarias como descendentes por muchos mediadores neuroquímicos, que incluyen endorfinas (p. ej., encefalina) y monoaminas (p. ej., serotonina, noradrenalina). Estos mediadores interactúan en formas poco conocidas para aumentar, sostener, abreviar o reducir la percepción del dolor y la respuesta a éste. Median el beneficio potencial de los agentes activos sobre el SNC (p. ej., opiáceos, antidepresivos, anticonvulsivos, estabilizadores de membrana) que interactúan con receptores específicos y sustancias neuroquímicas en el tratamiento del dolor crónico.
Los factores psicológicos son moduladores importantes. No sólo afectan el modo en que los pacientes hablan sobre el dolor (p. ej., si los pacientes parecen estoicos, irritables o la forma en que se quejan) y el modo en que se comportan con respecto al dolor (p. ej., si hacen muecas), sino también generan aferencias nerviosas que modulan la neurotransmisión a lo largo de las vías nerviosas. La reacción psicológica al dolor prolongado interactúa con otros factores del SNC para inducir cambios prolongados en la percepción del dolor.
DOLOR EN GERIATRÍA
En los ancianos, las causas más frecuentes de dolor son los trastornos musculoesqueléticos. Sin embargo, el dolor a menudo es crónico y multifactorial y las causas pueden no ser claras.
El riesgo de úlceras y hemorragia digestiva debido a AINE para las personas > 65 años es 3 a 4 veces mayor que en los de mediana edad. El riesgo depende de la dosis del fármaco y la duración del tratamiento. Los pacientes ancianos con alto riesgo de efectos adversos digestivos pueden beneficiarse con el uso simultáneo de agentes citoprotectores (habitualmente, un inhibidor de la bomba de protones; en ocasiones, la prostaglandina misoprostol).
El riesgo recién reconocido de toxicidad cardiovascular, que presumiblemente ocurre con los inhibidores no selectivos de la COX-1 y la COX-2 y con inhibidores selectivos de la COX-2 (coxibs). es particularmente relevante para los ancianos, los que tienen mayor probabilidad de presentar factores de riesgo cardiovasculares (p. ej., antecedentes de IAM o de enfermedad cerebrovascular o vascular periférica).
Tanto los AINE no selectivos como los selectivos pueden deteriorar la función renal y producir retención de Na y agua. Deben ser utilizados con precaución en los ancianos, sobre todo en aquellos que tienen un trastorno renal o hepático, insuficiencia cardíaca o hipovolemia. Pocas veces, los AINE producen deterioro cognitivo y cambios de personalidad en los ancianos. La indometacina produce mayor confusión en este grupo etario que otros AINE y debe ser evitada.
Dado el mayor riesgo global de una toxicidad grave en los ancianos, deben utilizarse bajas dosis de AINE siempre que sea posible y considerarse una terapia a corto plazo o una terapia interrumpida para confirmar la eficacia. Es más probable que los AINE alivien el dolor generado por la inflamación. El naproxeno puede ser preferible, ya que parece tener un menor riesgo de efectos adversos cardiovasculares que otros AINE comúnmente prescritos.
En los ancianos, los opiáceos tienen una vida media más larga y, posiblemente, mayor efecto analgésico que en los pacientes más jóvenes. En los pacientes ancianos con dolor crónico, el uso a corto plazo de los opiáceos parece reducir el dolor y mejorar el funcionamiento físico, pero parece afectar la función mental. El estreñimiento y la retención urinaria relacionados con los opiáceos tienden a ser más problemáticos en los ancianos. El riesgo de fractura durante las primeras 2 semanas de tratamiento con opiáceos es mayor que con los AINE en los ancianos.
En comparación con otros opiáceos, la buprenorfina transdérmica, un agonista/antagonista de los opiáceos, tiene un perfil riesgo:beneficio más favorable en los pacientes ancianos con insuficiencia renal.
FARMACOLOGIA CONTRA EL DOLOR: USOS, DOSIS, INDICACIONES
a. ANALGESICOS NO OPIACEOS
b. ANALGESICOS OPIACEOS
c. PARA EL DOLOR NEUROPATICO
Te apasionan las Neurociencias? A mi me vuelven loco. Tanto que ya lance tres libros: CEREBRA LA VIDA, CEREBRA LA SEXUALIDAD y CEREBRA LA EDUCACION. Te interesa sondear en los misterios del cerebro? Adelante. Acertaste el lugar.
martes, 6 de marzo de 2018
APUNTES SOBRE EL DOLOR
Suscribirse a:
Enviar comentarios (Atom)
LO QUE SUCEDE EN EL CEREBRO CUANDO DAMOS UNA BUENA CLASE
Artículo correspondiente a la columna dominical DE LA CABEZA del Diario La Nación correspondiente al domingo 10 de setiembre de 2023. Todo...

-
CARACTERISTICAS GENERALES La MEDULA ESPINAL es el sector mas caudal del SNC y asienta dentro del conducto raquideo formado por la conjunc...
-
Hoy tengo ganas de escribirles sobre las meninges, así que me voy a sacar el gusto. Tanto el cerebro, cerebelo, tronco cerebral y médula ...
-
Artículo correspondiente a la columna dominical DE LA CABEZA del Diario La Nación correspondiente al domingo 10 de setiembre de 2023. Todo...












No hay comentarios:
Publicar un comentario