Apuntes de las Clases desarrolladas el sabado 24 de febrero en la Catedra de Neurociencias Clinicas de la Carrera de Medicina de la UMAX.
Todos los derechos reservados.
Permitido su uso para estudio o apoyo docente. Prohibida su reproduccion total o parcial sin citar la fuente.
GENERALIDADES
Los traumatismos craneoencefalicos (TCE de ahora en mas) causan mayor número de muertes y discapacidad que cualquier otro trastorno neurológico antes de los 50 años de edad y se presenta en >70% de los accidentes, que son la principal causa de muerte en los varones < 35 años. La mortalidad por lesión grave se acerca al 50% y el tratamiento sólo la reduce ligeramente.
La lesión puede derivar de una herida penetrante craneal o de aceleración y deceleración cerebral rápida, que lesiona el tejido en el lugar del impacto, en el polo opuesto (contragolpe) o difusamente en los lóbulos frontales y temporales. El tejido nervioso, los vasos sanguíneos y las meninges pueden resultar desgarrados, arrancados o rotos, con la consecuente disrupción neural, isquemia o hemorragia intracerebral o extracerebral y edema.
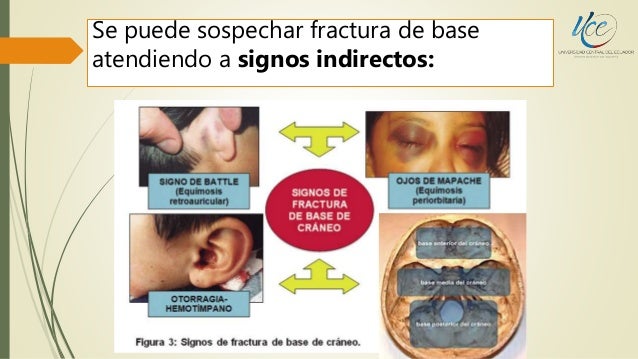
La hemorragia y el edema cerebral actúan como lesiones expansivas intracraneales, causando déficit neurológicos focales o aumento de la presión e hinchazón cerebral que pueden conducir a una herniación mortal del tejido cerebral a través del tentorio o del foramen magno. Las fracturas del cráneo pueden seccionar las arterias meníngeas o los grandes senos venosos, produciendo un hematoma subdural o epidural. Las fracturas, especialmente las de la base del cráneo, también pueden lacerar las meninges, causando una salida del LCR a través de las fosas nasales (rinorrea) o del oído (otorrea) o la entrada de bacterias y aire a través de la bóveda craneal. Los microorganismos pueden alcanzar las meninges a través de las fracturas ocultas, especialmente las que afectan a los senos paranasales.
CUADRO CLINICO
Concusion o conmocion cerebral. TCE leve.
La concusión se caracteriza por una pérdida transitoria postraumática de la atención o la memoria, de segundos a minutos de duración, sin causar lesiones estructurales detectables en el cerebro y sin dejar lesiones neurológicas residuales importantes.
Los pacientes con concusión raramente presentan arreactividad profunda. Las reacciones pupilares y otros signos de función del tronco del encéfalo están intactos; las respuestas plantares pueden ser extensoras durante un breve período de tiempo, pero no aparecen hemiplejía ni respuestas posturales de descerebración a los estímulos dolorosos. La punción lumbar generalmente está contraindicada en caso de traumatismo craneoencefálico (TCE), a menos que se sospeche una meningitis, y sólo debe ser realizada tras los estudios radiológicos apropiados.
El síndrome posconcusión generalmente sigue a un TCE leve y menos frecuentemente a uno moderado. Se caracteriza por cefalea, mareos, dificultad para concentrarse, amnesia variable, depresión, apatía y ansiedad. Puede dar lugar a una discapacidad considerable. La contribución de la lesión cerebral al síndrome no está clara. El síndrome posconcusión es más frecuente en pacientes con una disposición neurótica premórbida. Sin embargo, los estudios sugieren que incluso un traumatismo leve puede producir un daño neuronal. Aunque esta situación se presta a veces por sí misma a fingir o al fraude con la esperanza de compensaciones económicas, muchos pacientes presentan síntomas reales. Los beneficios del tratamiento farmacológico o psiquiátrico son inciertos.
Contusion cerebral
La contusión y laceración cerebral son lesiones más graves. Dependiendo de su importancia, están con frecuencia acompañadas de heridas graves en la superficie y de fracturas de la base del cráneo o fracturas deprimidas. Son comunes la hemiplejía y otros signos focales de disfunción cortical.
Edema cerebral
Las lesiones más graves pueden causar un edema cerebral importante, con rigidez de decorticación (miembros superiores flexionados y en aducción, los miembros inferiores y, a menudo el tronco, en extensión) o rigidez de descerebración (mandíbulas apretadas, hiperextensión del cuello y extensión de todos los miembros). El coma, la hemiplejía, la presencia de pupilas dilatadas y arreactivas unilateralmente o bilateralmente y la respiración irregular pueden ser secundarios al traumatismo inicial o a herniación cerebral interna y requieren tratamiento inmediato. El aumento de la presión intracraneal, que produce compresión o distorsión del TE, a veces causa un incremento de la presión arterial y enlentecimiento del pulso y la respiración (fenómeno de Cushing).
La TAC cerebral puede demostrar la presencia de LCR hemorrágico; la punción lumbar está contraindicada en términos generales. Los traumatismos no penetrantes suelen afectar fundamentalmente a los hemisferios cerebrales y el diencéfalo, que son más amplios y generalmente están más expuestos que el TE. Por otra parte, los signos de afectación primaria del tronco (coma, respiración irregular, pupilas fijas sin reacción a la luz, pérdida de los reflejos oculovestibulares, flaccidez motora difusa) casi siempre implican una lesión grave y un mal pronóstico. Las lesiones torácicas a menudo se asocian a los TCE graves, produciendo edema pulmonar (que en algunos casos es neurógeno), hipoxia e inestabilidad circulatoria.
Trauma raquimedular
Los traumatismos de la columna vertebral cervical pueden ir asociados a lesión medular, produciendo parálisis respiratoria mortal o cuadriplejía permanente. La inmovilización apropiada debe mantenerse hasta que la estabilidad de la columna cervical se confirme con las pruebas radiológicas apropiadas.
Hematoma subdural agudo
El hematoma subdural agudo (sangre entre la duramadre y la aracnoides, generalmente de origen venoso) y el hematoma intracerebral son frecuentes en el TCE grave y, junto con el edema cerebral grave, justifican la mayor parte de los fallecimientos por traumatismo. Las tres patologías pueden producir herniación transtentorial con coma profundo, aumento de la presión arterial diferencial, pupilas medias o dilatadas y fijas, hemiplejía espástica con hiperreflexia o cuadriplejía espástica y rigidez de decorticación odescerebración (debidas a deterioro rostrocaudal progresivo).
La TAC o RM generalmente pueden identificar las lesiones operables. La extirpación quirúrgica de lesiones extensas puede salvar la vida del paciente, aunque la morbilidad postraumática suele ser elevada.
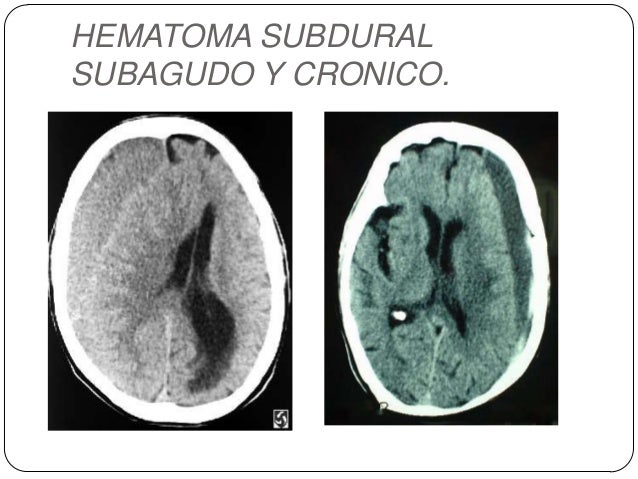
Hematoma subdural cronico
El hematoma subdural crónico puede ser asintomático durante varias semanas después del TCE. Aunque su diagnóstico precoz (entre 2 y 4 sem tras el traumatismo) es posible por deterioro neurológico retardado, la detección posterior puede pasarse por alto debido al lapso de tiempo transcurrido entre el traumatismo y el comienzo de los síntomas y signos.
Los hematomas subdurales son más frecuentes en alcohólicos y pacientes >50 años, en los que el traumatismo puede haber sido relativamente banal e incluso haberse olvidado. Son típicos la cefalea que aumenta con los días, la disminución del nivel de conciencia y la confusión fluctuantes (que pueden recordar al inicio de una demencia) y una hemiparesia de leve a moderada.
En los niños, el hematoma subdural crónico puede producir un aumento del perímetro cefálico que sugiere hidrocefalia. La RM es diagnóstica; la TAC puede ser menos específica para el diagnóstico.
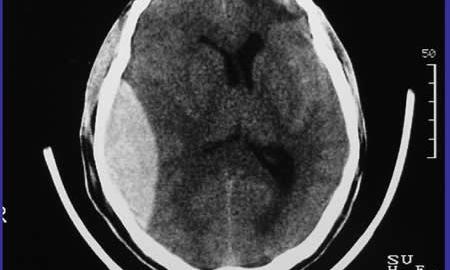
Hematoma epidural
El hematoma epidural consiste en la presencia de sangre entre el cráneo y la duramadre. Es secundario a hemorragia arterial, más frecuentemente por lesión de la arteria meníngea media. Los síntomas suelen desarrollarse en horas tras el TCE y consisten en cefalea progresiva, deterioro del nivel de conciencia, alteraciones motoras y cambios pupilares. Es típica la existencia de un intervalo «lúcido» con normalidad neurológica antes del comienzo de los síntomas.
El hematoma epidural es menos frecuente que el subdural, pero es importante porque su evacuación precoz puede prevenir la compresión y el desplazamiento cerebral rápido, evitando un déficit neurológico permanente o mortal. Las líneas de fractura pueden sugerir el diagnóstico, pero no siempre son visibles en la Rx de cráneo, por lo que debe realizarse una TAC, RM o angiografía urgente. Si no se dispone de estas técnicas, deben efectuarse trepanaciones urgentes para confirmar el diagnóstico y permitir la evacuación del coágulo.
Epilepsia postraumatica
La epilepsia postraumática, con crisis convulsivas que pueden comenzar tan tardíamente como varios años después del TCE, es consecuencia de aproximadamente un 10% de los traumatismos cerrados graves y un 40% de los traumatismos penetrantes.
Estado vegetativo persistente
El estado vegetativo persistente (crónico) (EVP) puede seguir a la forma más grave de TCE, la cual destruye todas las funciones cognitivas del cerebro anterior dejando indemne el tronco del encéfalo. El EVP puede prolongarse durante muchos años. En él, la capacidad de conocimiento y la actividad mental están ausentes, pero las funciones autónomas, los reflejos motores y los ciclos sueño-vigilia están preservados. Unos pocos pacientes pueden recuperarse cuando el EVP dura 3 meses tras el TCE, pero casi ninguno si persiste más de 6 meses
TRATAMIENTO
En el lugar del accidente.
Es probable que en los accidentes de tráfico existan múltiples lesiones, menos frecuentemente en las heridas por arma de fuego u otras lesiones craneales localizadas. Una vez asegurada la vía aérea y controladas las hemorragias agudas, el paciente debe ser trasladado en bloque, con especial cuidado en evitar el desplazamiento de la columna vertebral y otros huesos para prevenir lesiones de la médula espinal y los grandes vasos sanguíneos.
En el tratamiento inicial están contraindicados la morfina y otros fármacos depresores.
En el hospital.
Una vez que se ha establecido la vía aérea y una o varias vías i.v., deben evaluarse y tratarse las hemorragias internas y otras complicaciones urgentes. La hipoxia y la hipercapnia pueden agravar la lesión cerebral y habitualmente requieren respiración asistida.
La exploración incluye el nivel de conciencia, el patrón respiratorio, el tamaño y la reacción pupilar a la luz, la actividad oculomotora y la movilidad de los miembros.
Para la valoración inicial y la evolución de las respuestas se utiliza la escala del coma de Glasgow ; mediante esta escala y la observación de los cambios neurooftalmológicos, el médico puede valorar la gravedad de la lesión y su pronóstico.
Los signos neurológicos, la presión arterial, el pulso y la temperatura deben registrarse al menos cada hora, ya que cualquier indicio de deterioro requiere atención urgente.
La TAC o RM pueden detectar hematomas intracraneales potencialmente tratables quirúrgicamente y, si es posible, deben realizarse en todo paciente que sufra una pérdida de conciencia durante un tiempo >2 h o que presente alteraciones neurológicas focales.
Si estas pruebas no están disponibles, el paciente debe ser trasladado a un centro con mejor equipamiento médico.
La angiografía sólo está indicada si es imposible realizar una TAC o RM. El EEG y las tomografías radiactivas no tienen valor diagnóstico inmediatamente después del traumatismo.
La monitorización continua de la presión intracraneal (PIC) es frecuente en los pacientes con TCE grave. Los pacientes con concusión cerebral deben vigilarse estrechamente durante las primeras 24h. Si la TAC no muestra evidencia de hemorragia intracraneal o fracturas con desplazamiento y el paciente se encuentra neurológicamente indemne, no se requiere hospitalización. Para tomar esta decisión es útil la realización de una Rx de cráneo. Las fracturas craneales alineadas no requieren tratamiento. Las fracturas con depresión se tratan mejor en manos de un neurocirujano y pueden requerir tratamiento urgente cuando existe sección de algún vaso.
La profilaxis con antibióticos no se recomienda, ya que facilita la aparición de cepas resistentes, aunque suele utilizarse cuando existe rinorrea u otolicuorrea.
Los pacientes con TCE deben ser controlados de cerca y protegidos de las pérdidas de calor (hipotermia), de la hipertermia, la hiponatremia, las alteraciones del equilibrio hídrico y la obstrucción de la vía aérea. La hipoxemia arterial debe ser minimizada con oxigenoterapia parcial (40%), combinada, si es necesario, con presión positiva intermitente con respirador. La fiebre puede controlarse con paños fríos. Hay que restaurar precozmente las pérdidas hemáticas y de líquidos y estar alerta ante una posible insuficiencia renal aguda.
Las recomendaciones generales incluyen la administración de un antiepiléptico durante 2 sem si han habido crisis convulsivas o existe alguna lesion ocupante de espacio; por ejemplo, difenilhidantoína a dosis de ataque de 50 mg/min i.v. hasta un total de 1 g, seguido de 300 a 400 mg/d v.o. o i.v. Si no aparecen convulsiones en 2 sem, los antiepilépticos deben retirarse, ya que no se ha establecido su valor para prevenir futuras crisis.
Los diuréticos osmóticos (urea, manitol, glicerol) por vía i.v. reducen el edema cerebral pero deben reservarse para los pacientes con deterioro progresivo o para el tratamiento preoperatorio de pacientes con hematomas. En estos últimos se administra manitol, 12,5 a 25 g por vía i.v. a pasar en 15-30 min cada 1-4 h. Debe utilizarse con precaución en pacientes con cardiopatía o congestión vascular pulmonar, ya que induce una rápida expansión del volumen intravascular. Como los diuréticos osmóticos incrementan la excreción renal de agua a cambio del sodio, su uso prolongado puede producir depleción hídrica e hipernatremia. Por ello, se precisa un control estricto del balance hidroelectrolítico.
Los corticoides están contraindicados en los traumatismos craneoencefálicos.
La inquietud del paciente durante la recuperación del coma puede requerir sedación (p. ej., clorpromazina, 50 mg i.m., o haloperidol, 2 a 5mg i.m.).
Si el paciente comienza a recuperar la conciencia en la primera semana, el pronóstico vital es razonablemente bueno.
Durante la convalecencia.
Tras un TCE grave puede existir amnesia para los períodos inmediatamente anteriores y posteriores a la pérdida de conciencia. La amnesia retrógrada suele ser breve. La duración de la amnesia postraumática (medida hasta la recuperación completa y mantenida del nivel de conciencia normal) proporciona una estimación adecuada de la extensión del daño cerebral en los traumatismos cerrados.
La presencia de mareos, dificultades de concentración y de mantenimiento de la atención, ansiedad y cefaleas (síndrome postraumático o posconcusión, v.más atrás) suele aparecer durante un período de tiempo variable tras una concusión cerebral, pero es raro que requiera más tratamiento que reconfortar y tranquilizar al paciente.
La incapacidad residual debe ser valorada objetivamente. Los trastornos neuropsicológicos como el deterioro de la concentración, la atención y la memoria, así como los cambios leves o moderados de personalidad, son una causa más frecuente de alteración de las relaciones sociales y laborales que los déficit neurológicos específicos.
La anosmia postraumática, también relativamente frecuente, y la ceguera traumática aguda, más rara, no suelen resolverse. La hemiparesia y la afasia mejoran generalmente, excepto en ancianos o en pacientes con laceración cerebral grave. La mayoría de los casos de TCE grave (p. ej., con puntuación inicial al ingreso en la escala de Glasgow<8 175-1="" 2="" 6="" a="" adultos="" benefician="" br="" continuar="" convalecencia.="" de="" del="" durante="" en="" grave="" gravedad="" incluso="" independientemente="" inmediata="" la="" leve="" los="" lugar="" m="" mayor="" mejor="" mejorando="" meses="" mucho="" n="" ni="" os="" parte="" presentan="" primeros="" puede="" recuperaci="" rehabilitador="" s.="" s="" se="" suelen="" tabla="" tce="" tiempo.="" tiene="" tras="" tratamiento="" traumatismo="" ulterior="" un="" una="" v.="" y=""> <8 175-1="" 2="" 6="" a="" adultos="" benefician="" br="" continuar="" convalecencia.="" de="" del="" durante="" en="" grave="" gravedad="" incluso="" independientemente="" inmediata="" la="" leve="" los="" lugar="" m="" mayor="" mejor="" mejorando="" meses="" mucho="" n="" ni="" os="" parte="" presentan="" primeros="" puede="" recuperaci="" rehabilitador="" s.="" s="" se="" suelen="" tabla="" tce="" tiempo.="" tiene="" tras="" tratamiento="" traumatismo="" ulterior="" un="" una="" v.="" y="">
ABREVIATURAS USADAS
TCE: Traumatismo Craneoencefalico
TE: Tejido Encefalico
PIC: Presion intracraneana
TAC: Tomografia Axial Computarizada
RMN: Resonancia Magnetica Nuclear
LCR: Liquido cefalorraquideo
EVP: Estado Vegetativo Persistente